Post 58: Algunas proteínas son muy raras 🧐
Published:
La realidad tiene el capricho de ser commpleja.
Todos tenemos en mente como luce una alfa helice. Sin embargo, si usamos una mezcla de alcoholes como solvente podemos obtener una helice cuyo plegamiento se parece a la estructrua del ADN. O incluso podemos encontrar casos de helices compuestas por betas plegadas-
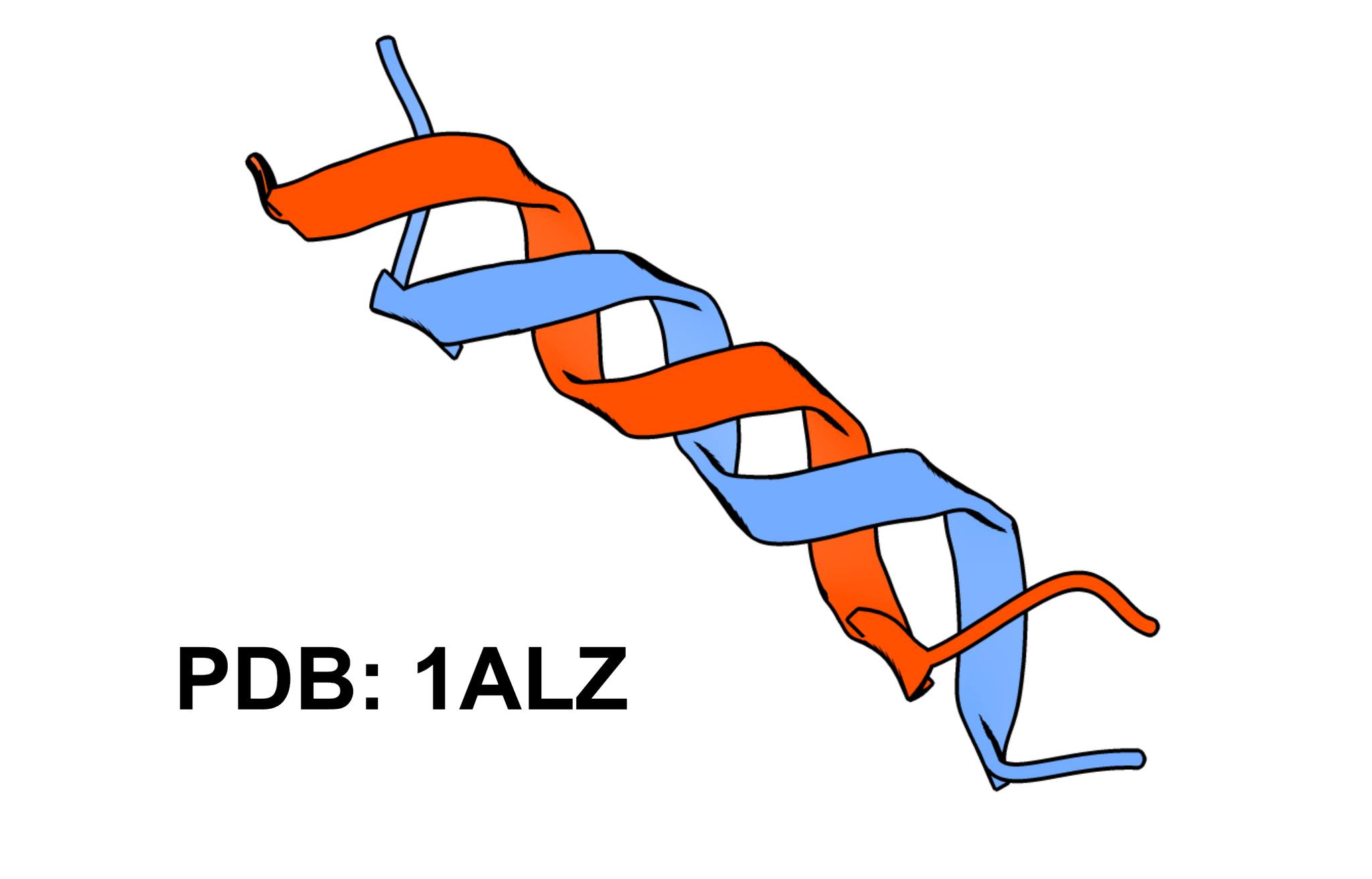
Otro comportamiento que podria parecer extraño es el nivel de simetría de ciertas proteínas que a veces resulta “estéticamente perturbadora”. Por ejemplo, la bacteria Brocadia sapporoensis tiene una proteína compuesta 11 subunidades de hojas beta repetidas.
Pero, ¿por qué ocurre esto? Se supone que los péptidos primordiales eran pequeños servían de cofactores a ribozimas. Luego se empezaron a duplicar y oligomerizar formando péptidos de alta simetría interna. Debieron haber sido péptidos que además de ser formados solo por los 10 aa prebióticos, tuvieran suficientes puentes de H para porder oligamerizarse con otras cadenas adyacentes. Y probablemente fueron motifs simples y “fáciles de recordar” como para poder haber tenido éxito al replicarse, siguiendo las “leyes” de la memetica. De ahí las primeras enzimas empezaron a surgir, pues en los recovecos de las interfaces es donde se suelen unir más sustratos tipo nucleótidos y fosfo-ligandos; eventualmente diversificando a las diversas habilidades catalíticas de las enzimas actuales mediante la combinación de dominios con mecanismos a nivel genético (como los transposones y mutaciones) y a nivel proteína (como las permutaciones circulares o splicing).
Desde el punto de vista evo, tener repeticiones de alta simetría promueve estructuras estables como se ve con puentes de H en cyan. Y a nivel genético era fácil tener una copia simple y pequeña que repetir y repetir. Además de que por la distribución se fenotipos se supone la evolución tiende a sesgarse a soluciones simples al simularlo con algoritmos genéticos.
La presencia de dominios de alta simetría en las proteínas actuales ya no es tal como lo era en sus primeros pasos. Si no mal recuerdo anda por ahí del 20% de los dominios de la CATH. Ahora tenemos toda una maquinaria diversificada que ya no se ve favorecida funcionalmente a la simetría. Pero en la Tierra primitiva pues sí. En resumen, la evolución aprovecho el bug 😅
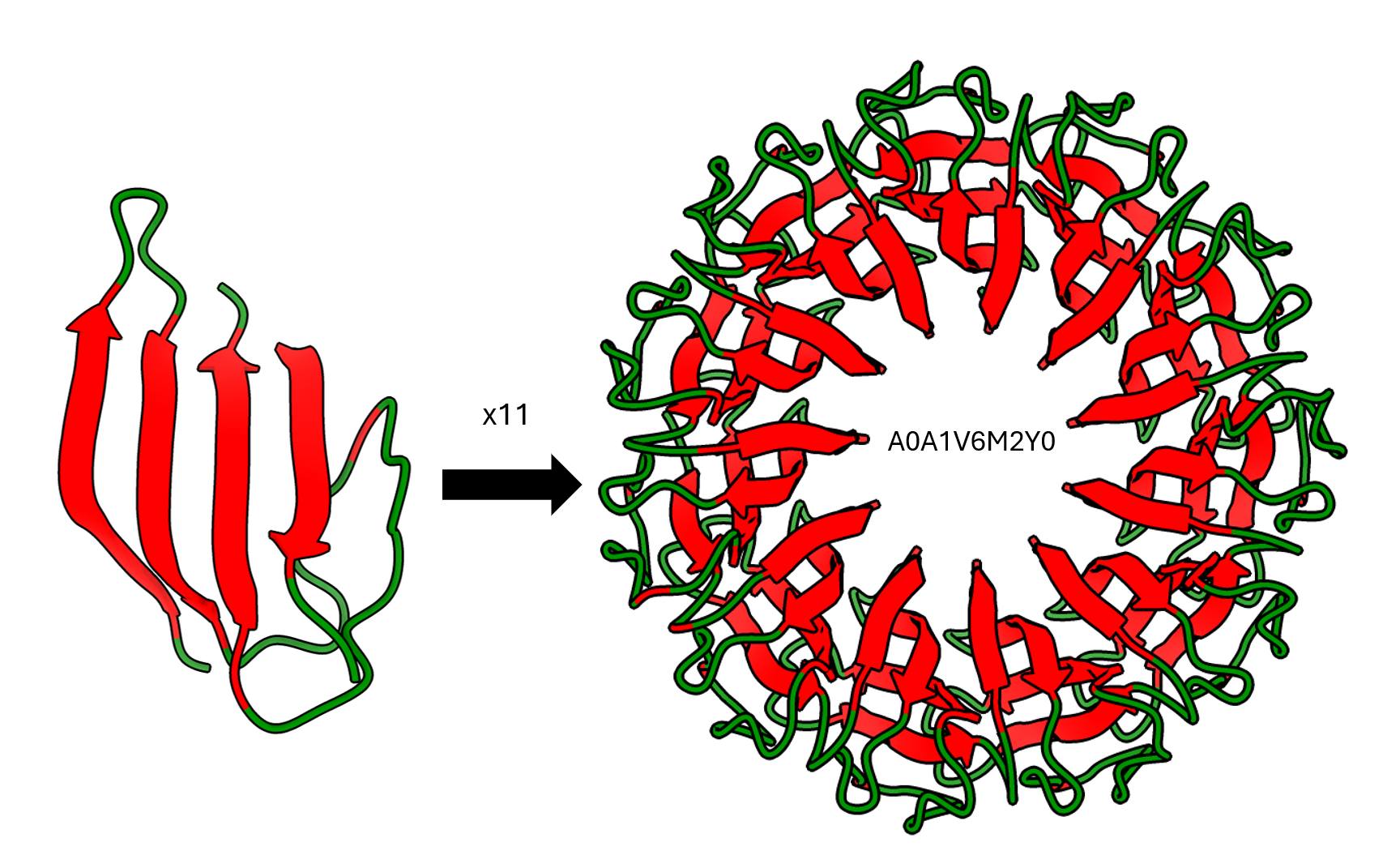
Y si mostramos la superficie de la proteína anterior podemos ver algo muy interesante. Si la evolución no planifica, entonces, por qué hizo un proteína con forma de dona de chocolate? 🤔

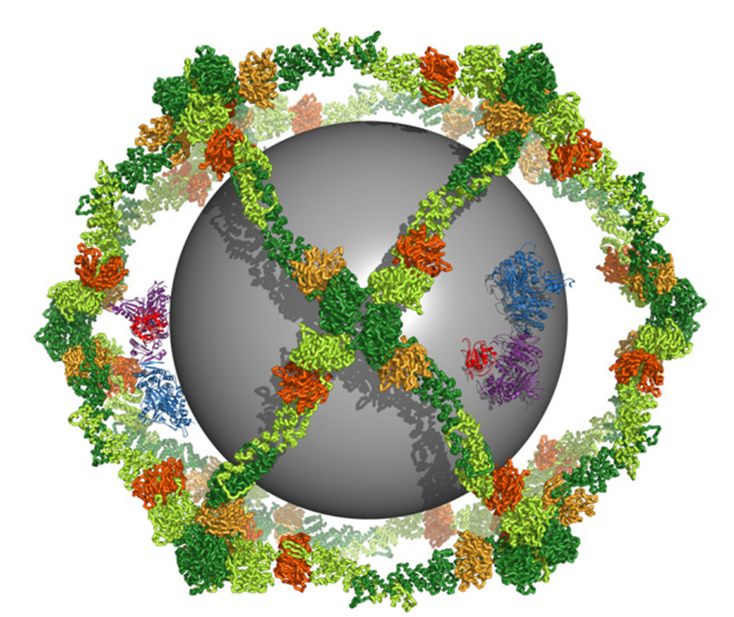
No solo eso, la evolución ha combinado dominios para formar proteinas bastante fuera de lo común. Hasta parece que la evolución ya construyó una esfera de Dyson con puras proteínas, pero como está dentro de nosotros, muy ocupada chambiando para mantenernos vivos, nadie nadie le presta atencíon.
Structure and Organization of Coat Proteins in the COPII Cage
Como tal los dominios que componen la COPII no absorven energia como una esfera de Dyson. Pero en su arquitectura si son bastante similares. Obviamente para ser traducidas si la consumen, como todo. Sin embargo si hay proteinas que pueden “extraer energia de la nada” (osea, la atmosfera), equivalente a lo pretendido por la esfera de Dyson:
Structural basis for bacterial energy extraction from atmospheric hydrogen
Incluso hay proteinas con formas muy graciosas que me hacen pensar: si, “dios” no juega a los dados. Pero si juega baloncesto, si no para que haría una canasta molecular hecha con proteínas? 🤨
The molecular architecture of the nuclear basket

Asi que mejor hay que tener cuidado con las proteínas (Render por Verena Resch https://luminous-lab.com/)

